
அனைத்து iLive உள்ளடக்கம் மருத்துவ ரீதியாக மதிப்பாய்வு செய்யப்படும் அல்லது முடிந்தவரை உண்மையான துல்லியத்தை உறுதி செய்ய உண்மையில் சரிபார்க்கப்படுகிறது.
நாம் கடுமையான ஆதார வழிகாட்டுதல்களை கொண்டிருக்கிறோம் மற்றும் மரியாதைக்குரிய ஊடக தளங்கள், கல்வி ஆராய்ச்சி நிறுவனங்கள் மற்றும் சாத்தியமான போதெல்லாம், மருத்துவ ரீதியாக மதிப்பாய்வு செய்யப்பட்ட படிப்புகளை மட்டுமே இணைக்கிறோம். அடைப்புக்களில் உள்ள எண்கள் ([1], [2], முதலியன) இந்த ஆய்வுகள் தொடர்பான கிளிக் செய்யக்கூடியவை என்பதை நினைவில் கொள்க.
எங்கள் உள்ளடக்கத்தில் எதையாவது தவறாக, காலதாமதமாக அல்லது சந்தேகத்திற்குரியதாகக் கருதினால், தயவுசெய்து அதைத் தேர்ந்தெடுத்து Ctrl + Enter ஐ அழுத்தவும்.
மனித நோயெதிர்ப்பு குறைபாடு வைரஸ் (எச்.ஐ.வி)
கட்டுரை மருத்துவ நிபுணர்
கடைசியாக மதிப்பாய்வு செய்யப்பட்டது: 04.07.2025
1981 ஆம் ஆண்டு அமெரிக்காவில், பல இளைஞர்கள் ஆரோக்கியமான மக்களுக்கு நோய்க்கிருமி அல்லாத அல்லது பலவீனமான நோய்க்கிருமி நுண்ணுயிரிகளால் ஏற்படும் கடுமையான நோய்களை உருவாக்கியபோது, வாங்கிய நோயெதிர்ப்பு குறைபாடு நோய்க்குறி ஒரு குறிப்பிட்ட நோயாக அடையாளம் காணப்பட்டது. நோயாளிகளின் நோயெதிர்ப்பு நிலை பற்றிய ஆய்வில், பொதுவாக லிம்போசைட்டுகளின் எண்ணிக்கையிலும், குறிப்பாக டி-ஹெல்பர்களின் எண்ணிக்கையிலும் கூர்மையான குறைவு இருப்பது தெரியவந்தது. இந்த நிலை எய்ட்ஸ் (பெற்ற நோயெதிர்ப்பு குறைபாடு நோய்க்குறி) என்று அழைக்கப்பட்டது. தொற்று முறை (பாலியல் தொடர்பு, இரத்தம் மற்றும் அதன் தயாரிப்புகள் மூலம்) நோயின் தொற்று தன்மையைக் குறிக்கிறது.
எய்ட்ஸ் நோய்க்கான காரணியை 1983 ஆம் ஆண்டு பிரெஞ்சுக்காரர் எல். மாண்டாக்னியர் சுயாதீனமாகக் கண்டுபிடித்தார், அவர் லிம்பேடனோபதி நோயாளியிடம் இதைக் கண்டறிந்ததால் அதை LAV லிம்போஅடெனோபதி அசோசியேட்டட் வைரஸ் என்று அழைத்தார்; மேலும் அமெரிக்கரான ஆர். காலோ, வைரஸை HTLV-III (மனித டி-லிம்போட்ரோபிக் வைரஸ் III) என்று அழைத்தார்: அவர் முன்பு லிம்போட்ரோபிக் வைரஸ்கள் I மற்றும் II ஐக் கண்டுபிடித்திருந்தார்.
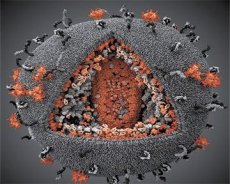
LAV மற்றும் HTLV-III வைரஸ்களின் பண்புகளை ஒப்பிட்டுப் பார்த்தபோது அவற்றின் அடையாளம் தெரிந்தது, எனவே குழப்பத்தைத் தவிர்க்க, 1986 ஆம் ஆண்டில் இந்த வைரஸுக்கு HIV (மனித நோயெதிர்ப்பு குறைபாடு வைரஸ் அல்லது HIV) என்று பெயரிடப்பட்டது. HIV கோள வடிவில் உள்ளது, 110 nm விட்டம் கொண்டது. வைரஸ் உறை 12 பென்டகன்கள் மற்றும் 20 அறுகோணங்களைக் கொண்ட பாலிஹெட்ரான் வடிவத்தைக் கொண்டுள்ளது. ஒவ்வொரு அறுகோணத்தின் மையத்திலும் மூலைகளிலும் கிளைகோசைலேட்டட் புரதம் gpl20 இன் மூலக்கூறு உள்ளது (எண் 120 என்பது கிலோடால்டன்களில் புரதத்தின் மூலக்கூறு எடையைக் குறிக்கிறது). மொத்தம் 72 gpl20 மூலக்கூறுகள் விரியனின் மேற்பரப்பில் விசித்திரமான கூர்முனைகளின் வடிவத்தில் அமைந்துள்ளன, அவை ஒவ்வொன்றும் உள்சவ்வு புரதம் gp41 உடன் தொடர்புடையது. இந்த புரதங்கள், இரட்டை லிப்பிட் அடுக்குடன் சேர்ந்து, விரியனின் சூப்பர் கேப்சிட் (சவ்வு) ஐ உருவாக்குகின்றன.
Gpl20 மற்றும் gp41 புரதங்கள், Env முன்னோடி புரதத்தை ஒரு செல்லுலார் புரோட்டீஸால் வெட்டுவதன் மூலம் உருவாகின்றன. gp41 புரதம் அதன் சைட்டோபிளாஸ்மிக் டொமைனுடன் நேரடியாக உறையின் கீழ் அமைந்துள்ள மேட்ரிக்ஸ் புரதம் p17MA உடன் பிணைப்பதன் மூலம் ஸ்பைக் "தண்டு" ஐ உருவாக்குகிறது. p17 மூலக்கூறுகள் விரியன் முதிர்ச்சியின் போது தொடர்பு கொண்டு உறையின் அடியில் ஒரு ஐகோசஹெட்ரானை உருவாக்குகின்றன.
விரியனின் மையப் பகுதியில், p24 புரதம் ஒரு கூம்பு வடிவ கேப்சிட்டை உருவாக்குகிறது. கேப்சிட்டின் குறுகலான பகுதி rb புரதத்தின் பங்கேற்புடன் விரியன் சவ்வுடன் இணைக்கப்பட்டுள்ளது. கேப்சிட்டின் உள்ளே, வைரஸ் ஜெனோமிக் ஆர்.என்.ஏவின் இரண்டு ஒத்த மூலக்கூறுகள் உள்ளன. அவை அவற்றின் 5' முனைகளால் நியூக்ளியோகாப்சிட் புரதம் p7NC உடன் இணைக்கப்பட்டுள்ளன. இந்த புரதம் சுவாரஸ்யமானது, ஏனெனில் இது சிஸ்டைன் மற்றும் ஹிஸ்டைடின் நிறைந்த இரண்டு அமினோ அமில எச்சங்கள் (மையங்கள்) மற்றும் ஒரு Zn அணுவைக் கொண்டுள்ளது - அவை உருவாக்கும் விரியன்களில் சேர்ப்பதற்காக மரபணு ஆர்.என்.ஏவின் மூலக்கூறுகளைப் பிடிக்கின்றன என்பதால் அவை "துத்தநாக விரல்கள்" என்று அழைக்கப்படுகின்றன. கேப்சிட்டில் மூன்று நொதிகளும் உள்ளன. ரிவர்டேஸ் (RT), அல்லது pol சிக்கலானது, தலைகீழ் டிரான்ஸ்கிரிப்டேஸ், RNase H மற்றும் DNA-சார்ந்த டி.என்.ஏ பாலிமரேஸ் ஆகியவற்றை உள்ளடக்கியது. ரிவர்டேஸ் ஒரு ஹெட்டோரோடைமர் p66/p51 ஆக உள்ளது. புரோட்டீஸ் (PR) - p10, விரியன் முதிர்ச்சி செயல்முறையைத் தொடங்கி செயல்படுத்துகிறது. இன்டெக்ரேஸ் (IN) - p31, அல்லது எண்டோநியூக்லீஸ், ஹோஸ்ட் செல் மரபணுவில் புரோவைரல் டிஎன்ஏவைச் சேர்ப்பதை உறுதி செய்கிறது. கேப்சிட் ப்ரைமர் ஆர்என்ஏ (tRNAl"3) மூலக்கூறையும் கொண்டுள்ளது.
செல்லில் உள்ள ஆர்.என்.ஏ மரபணு, 9283 நியூக்ளியோடைடு ஜோடிகளைக் கொண்ட ரிவர்ஸ் டிரான்ஸ்கிரிப்டேஸின் உதவியுடன் டி.என்.ஏ மரபணுவாக (டி.என்.ஏ புரோவைரஸ்) மாற்றப்படுகிறது. இது இடது மற்றும் வலதுபுறத்தில் நீண்ட முனைய மறுநிகழ்வுகள் அல்லது எல்.டி.ஆர்கள் என்று அழைக்கப்படுபவற்றால் வரையறுக்கப்பட்டுள்ளது: இடதுபுறத்தில் எஸ்'-எல்.டி.ஆர் மற்றும் வலதுபுறத்தில் 3'-எல்.டி.ஆர்.. எல்.டி.ஆர்.களில் ஒவ்வொன்றும் 638 நியூக்ளியோடைடு ஜோடிகளைக் கொண்டுள்ளன.
எச்.ஐ.வி மரபணு 9 மரபணுக்களைக் கொண்டுள்ளது, அவற்றில் சில முனைகளில் ஒன்றுடன் ஒன்று (பல வாசிப்பு பிரேம்களைக் கொண்டுள்ளன) மற்றும் ஒரு எக்ஸோனின்ட்ரான் அமைப்பைக் கொண்டுள்ளன. அவை 9 கட்டமைப்பு மற்றும் 6 ஒழுங்குமுறை புரதங்களின் தொகுப்பைக் கட்டுப்படுத்துகின்றன.
வைரஸ் மரபணுவிற்கு LTR-களின் முக்கியத்துவம் என்னவென்றால், அவை அதன் செயல்பாட்டைக் கட்டுப்படுத்தும் பின்வரும் ஒழுங்குமுறை கூறுகளைக் கொண்டுள்ளன:
- டிரான்ஸ்கிரிப்ஷன் சிக்னல் (விளம்பரப் பகுதி);
- பாலி-ஏ கூட்டல் சமிக்ஞை;
- மூடி சமிக்ஞை;
- ஒருங்கிணைப்பு சமிக்ஞை;
- நேர்மறை ஒழுங்குமுறை சமிக்ஞை (TAT புரதத்திற்கான TAR);
- எதிர்மறை ஒழுங்குமுறை உறுப்பு (NEF புரதத்திற்கான NRE);
- 3' முனையில் மைனஸ்-ஸ்ட்ராண்ட் டிஎன்ஏ தொகுப்புக்கான ப்ரைமர் ஆர்என்ஏ (tRNA™3) இணைப்பிற்கான ஒரு தளம்; பிளஸ்-ஸ்ட்ராண்ட் டிஎன்ஏ தொகுப்புக்கான ப்ரைமராகச் செயல்படும் LTR இன் 5' முனையில் ஒரு சமிக்ஞை.
கூடுதலாக, LTR, mRNA பிளவுபடுதலை ஒழுங்குபடுத்துவதில் ஈடுபடும் கூறுகளைக் கொண்டுள்ளது, vRNA மூலக்கூறுகளை கேப்சிட்டில் (Psi உறுப்பு) பேக்கேஜிங் செய்கிறது. இறுதியாக, மரபணு படியெடுத்தலின் போது, REV புரதத்திற்கான நீண்ட mRNAக்களில் இரண்டு சமிக்ஞைகள் உருவாகின்றன, அவை புரதத் தொகுப்பை மாற்றுகின்றன: CAR - ஒழுங்குமுறை புரதங்களுக்கு மற்றும் CRS - கட்டமைப்பு புரதங்களுக்கு. REV புரதம் CAR உடன் பிணைந்தால், கட்டமைப்பு புரதங்கள் ஒருங்கிணைக்கப்படுகின்றன; அது இல்லாவிட்டால், ஒழுங்குமுறை புரதங்கள் மட்டுமே ஒருங்கிணைக்கப்படுகின்றன.
வைரஸ் மரபணுவின் செயல்பாட்டை ஒழுங்குபடுத்துவதில் பின்வரும் ஒழுங்குமுறை மரபணுக்களும் அவற்றின் புரதங்களும் குறிப்பாக முக்கிய பங்கு வகிக்கின்றன:
- வைரஸ் பிரதிபலிப்பின் நேர்மறையான கட்டுப்பாட்டை மேற்கொள்ளும் மற்றும் TAR ஒழுங்குமுறை பகுதி வழியாக செயல்படும் TAT புரதம்;
- NRE பகுதி வழியாக நகலெடுப்பதில் எதிர்மறையான கட்டுப்பாட்டைச் செலுத்தும் NEV மற்றும் VPU புரதங்கள்;
- நேர்மறை-எதிர்மறை கட்டுப்பாட்டை மேற்கொள்ளும் REV புரதம். REV புரதம் காக், போல், என்வி மரபணுக்களின் வேலையைக் கட்டுப்படுத்துகிறது மற்றும் பிளவுபடுதலின் எதிர்மறை ஒழுங்குமுறையைச் செய்கிறது.
இதனால், எச்.ஐ.வி பிரதிபலிப்பு மூன்று கட்ட கட்டுப்பாட்டின் கீழ் உள்ளது - நேர்மறை, எதிர்மறை மற்றும் நேர்மறை-எதிர்மறை.
புதிதாக ஒருங்கிணைக்கப்பட்ட வைரஸின் தொற்றுத்தன்மையை VIF புரதம் தீர்மானிக்கிறது. இது p24 கேப்சிட் புரதத்துடன் தொடர்புடையது மற்றும் 60 மூலக்கூறுகளின் அளவில் விரியனில் உள்ளது. NEF புரதம் விரியனில் ஒரு சிறிய எண்ணிக்கையிலான மூலக்கூறுகளால் (5-10) குறிப்பிடப்படுகிறது, இது உறையுடன் தொடர்புடையதாக இருக்கலாம்.
VPR புரதம் G2 கட்டத்தில் செல் சுழற்சியைத் தடுக்கிறது, முன் ஒருங்கிணைப்பு வளாகங்களை செல் கருவுக்குள் கொண்டு செல்வதில் பங்கேற்கிறது, சில வைரஸ் மற்றும் செல்லுலார் மரபணுக்களை செயல்படுத்துகிறது, மேலும் மோனோசைட்டுகள் மற்றும் மேக்ரோபேஜ்களில் வைரஸ் பிரதிபலிப்பின் செயல்திறனை அதிகரிக்கிறது. விரியனில் VPR, TAT, REV மற்றும் VPU புரதங்களின் இருப்பிடம் நிறுவப்படவில்லை.
அதன் சொந்த புரதங்களுடன் கூடுதலாக, விரியன் சவ்வு ஹோஸ்ட் செல்லின் சில புரதங்களைக் கொண்டிருக்கலாம். VPU மற்றும் VPR புரதங்கள் வைரஸ் இனப்பெருக்கத்தை ஒழுங்குபடுத்துவதில் பங்கேற்கின்றன.
மனித நோயெதிர்ப்பு குறைபாடு வைரஸின் (HIV) ஆன்டிஜெனிக் வகைகள்
மனித நோயெதிர்ப்பு குறைபாடு வைரஸ் (HIV) மிகவும் மாறுபடும். ஒரு நோயாளியின் உடலில் இருந்து கூட, ஆன்டிஜெனிக் பண்புகளில் கணிசமாக வேறுபடும் வைரஸ் விகாரங்களை தனிமைப்படுத்த முடியும். CD4+ செல்களின் தீவிர அழிவு மற்றும் HIV தொற்றுக்கு சக்திவாய்ந்த ஆன்டிபாடி எதிர்வினை மூலம் இத்தகைய மாறுபாடு எளிதாக்கப்படுகிறது. HIV-1 க்கு உயிரியல் ரீதியாக நெருக்கமான ஆனால் நோயெதிர்ப்பு ரீதியாக அதிலிருந்து வேறுபட்ட HIV இன் புதிய வடிவமான HIV-2, மேற்கு ஆப்பிரிக்காவிலிருந்து நோயாளிகளிடமிருந்து தனிமைப்படுத்தப்பட்டுள்ளது. இந்த வைரஸ்களின் மரபணுக்களின் முதன்மை கட்டமைப்பின் ஹோமோலஜி 42% ஆகும். DNA புரோவைரஸ் HIV-2 9671 bp ஐக் கொண்டுள்ளது, மேலும் அதன் LTR - 854 bp ஆகும். பின்னர் உலகின் பிற பகுதிகளில் HIV-2 தனிமைப்படுத்தப்பட்டது. HIV-1 மற்றும் HIV-2 க்கு இடையில் குறுக்கு-நோய் எதிர்ப்பு சக்தி இல்லை. HIV-1 இன் இரண்டு பெரிய வடிவங்கள் அறியப்படுகின்றன: O (அவுட்லியர்) மற்றும் M (மேஜர்), பிந்தையது 10 துணை வகைகளாக (AJ) பிரிக்கப்பட்டுள்ளது. எட்டு துணை வகைகள் (AH) ரஷ்யாவில் பரவுகின்றன.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
உயிரணுவுடன் எச்.ஐ.வி தொடர்பு கொள்ளும் வழிமுறை
உடலில் ஊடுருவிய பிறகு, வைரஸ் முதலில் அதற்குரிய CD4 ஏற்பியைக் கொண்ட செல்களைத் தாக்குகிறது. இந்த ஏற்பி T-உதவி செல்களில் அதிக அளவிலும், மேக்ரோபேஜ்கள் மற்றும் மோனோசைட்டுகளில் சிறிய அளவிலும் உள்ளது, மேலும் T-உதவி செல்களில் வைரஸுக்கு குறிப்பாக உணர்திறன் உள்ளது.
மனித நோயெதிர்ப்பு குறைபாடு வைரஸ் (HIV) அதன் gpl20 புரதத்தைப் பயன்படுத்தி CD4 ஏற்பிகளை அங்கீகரிக்கிறது. கலத்துடன் HIV தொடர்பு கொள்ளும் செயல்முறை பின்வரும் திட்டத்தின் படி நிகழ்கிறது: ஏற்பி-மத்தியஸ்த உறிஞ்சுதல் -> பூசப்பட்ட குழி -> பூசப்பட்ட வெசிகல் -> லைசோசோம். அதில், விரியன் சவ்வு லைசோசோம் சவ்வுடன் இணைகிறது, மேலும் நியூக்ளியோகாப்சிட், சூப்பர் கேப்சிட்டிலிருந்து விடுவிக்கப்பட்டு, சைட்டோபிளாஸத்திற்குள் நுழைகிறது; கருவுக்குச் செல்லும் வழியில், அது அழிக்கப்படுகிறது, மேலும் மரபணு RNA மற்றும் தொடர்புடைய மைய கூறுகள் வெளியிடப்படுகின்றன. பின்னர், தலைகீழ் டிரான்ஸ்கிரிப்டேஸ் விரியன் RNA இல் உள்ள DNA இன் மைனஸ் ஸ்ட்ராண்டை ஒருங்கிணைக்கிறது, பின்னர் RNase H விரியன் RNA ஐ அழிக்கிறது, மேலும் வைரஸ் DNA பாலிமரேஸ் DNA இன் பிளஸ் ஸ்ட்ராண்டை ஒருங்கிணைக்கிறது. 5'-LTR மற்றும் 3'-LTR ஆகியவை டிஎன்ஏ புரோவைரஸின் முனைகளில் உருவாகின்றன. டிஎன்ஏ புரோவைரஸ் சிறிது நேரம் செயலற்ற வடிவத்தில் கருவில் இருக்க முடியும், ஆனால் விரைவில் அல்லது பின்னர் அது அதன் ஒருங்கிணைப்பின் உதவியுடன் இலக்கு செல்லின் குரோமோசோமில் ஒருங்கிணைக்கப்படுகிறது. இதில், கொடுக்கப்பட்ட T-லிம்போசைட் நுண்ணுயிர் ஆன்டிஜென்கள் அல்லது பிற நோயெதிர்ப்பு திறன் கொண்ட செல்களால் செயல்படுத்தப்படும் வரை புரோவைரஸ் செயலற்ற நிலையில் இருக்கும். செல்லுலார் டிஎன்ஏ டிரான்ஸ்கிரிப்ஷனை செயல்படுத்துவது ஒரு சிறப்பு அணுக்கரு காரணி (NF-kB) மூலம் கட்டுப்படுத்தப்படுகிறது. இது ஒரு டிஎன்ஏ-பிணைப்பு புரதமாகும், மேலும் டி-லிம்போசைட்டுகள் மற்றும் மோனோசைட்டுகளின் செயல்படுத்தல் மற்றும் பெருக்கத்தின் போது அதிக அளவில் உற்பத்தி செய்யப்படுகிறது. இந்த புரதம் செல்லுலார் டிஎன்ஏவின் சில வரிசைகள் மற்றும் டிஎன்ஏ புரோவைரஸின் ஒத்த எல்டிஆர் வரிசைகளுடன் பிணைக்கிறது மற்றும் செல்லுலார் டிஎன்ஏ மற்றும் டிஎன்ஏ புரோவைரஸ் இரண்டின் டிரான்ஸ்கிரிப்ஷனையும் தூண்டுகிறது. டிஎன்ஏ புரோவைரஸின் டிரான்ஸ்கிரிப்ஷனைத் தூண்டுவதன் மூலம், இது வைரஸை ஒரு செயலற்ற நிலையிலிருந்து செயலில் உள்ள நிலைக்கு மாற்றுகிறது, அதன்படி, ஒரு தொடர்ச்சியான தொற்றுநோயிலிருந்து உற்பத்தி நிலைக்கு மாற்றுகிறது. புரோவைரஸ் மிக நீண்ட காலத்திற்கு செயலற்ற நிலையில் இருக்க முடியும். வைரஸை செயல்படுத்துவது என்பது செல்லுடனான அதன் தொடர்புகளில் ஒரு முக்கியமான தருணமாகும்.
வைரஸ் செல்லுக்குள் ஊடுருவிய தருணத்திலிருந்து, எச்.ஐ.வி தொற்று காலம் தொடங்குகிறது - வைரஸ் கேரியர் நிலை, இது 10 ஆண்டுகள் அல்லது அதற்கு மேல் நீடிக்கும்; மேலும் வைரஸ் செயல்படுத்தப்பட்ட தருணத்திலிருந்து, நோய் தொடங்குகிறது - எய்ட்ஸ். அதன் ஒழுங்குமுறை மரபணுக்கள் மற்றும் அவற்றின் தயாரிப்புகளின் உதவியுடன், வைரஸ் தீவிரமாக இனப்பெருக்கம் செய்யத் தொடங்குகிறது. TAT புரதம் வைரஸ் இனப்பெருக்க விகிதத்தை 1000 மடங்கு அதிகரிக்க முடியும். வைரஸ் படியெடுத்தல் சிக்கலானது. இது முழு நீள மற்றும் துணை மரபணு mRNA இரண்டின் உருவாக்கத்தையும், mRNA பிளவுபடுதலையும் உள்ளடக்கியது, பின்னர் கட்டமைப்பு மற்றும் ஒழுங்குமுறை புரதங்களின் தொகுப்பு ஏற்படுகிறது.
கட்டமைப்பு புரதங்களின் தொகுப்பு பின்வருமாறு நிகழ்கிறது. முதலாவதாக, Pr55Gag முன்னோடி பாலிபுரோட்டீன் (55 kDa மூலக்கூறு எடை கொண்ட ஒரு புரதம்) ஒருங்கிணைக்கப்படுகிறது. இது 4 முக்கிய களங்களைக் கொண்டுள்ளது: மேட்ரிக்ஸ் (MA), கேப்சிட் (CA), நியூக்ளியோகாப்சிட் (NC), மற்றும் rb டொமைன், இதிலிருந்து, வைரஸ் புரோட்டீஸால் Pr55Gag ஐ வெட்டுவதன் விளைவாக (இது மற்றொரு முன்னோடி புரதமான Gag-Pol இலிருந்து சுயமாக வெட்டப்படுகிறது), கட்டமைப்பு புரதங்கள் p17, p24, p7 மற்றும் rb ஆகியவை முறையே உருவாகின்றன. Pr55Gag பாலிபுரோட்டீனின் உருவாக்கம் வைரஸ் துகள்கள் உருவாவதற்கான முக்கிய நிபந்தனையாகும். இந்த புரதம்தான் விரியன் மார்போஜெனிசிஸ் திட்டத்தை தீர்மானிக்கிறது. இது தொடர்ச்சியாக காக் பாலிபுரோட்டீனை பிளாஸ்மா சவ்வுக்கு கொண்டு செல்லும் நிலைகள், அதனுடன் தொடர்பு கொள்வது மற்றும் வைரஸ் துகள் மற்றும் அதன் அரும்புதல் ஆகியவற்றின் போது புரத-புரத தொடர்புகளை உள்ளடக்கியது. Pr55Gag இலவச பாலிரிபோசோம்களில் ஒருங்கிணைக்கப்படுகிறது; புரத மூலக்கூறுகள் சவ்வுக்கு கொண்டு செல்லப்படுகின்றன, அங்கு அவை அவற்றின் ஹைட்ரோபோபிக் பகுதிகளால் நங்கூரமிடப்படுகின்றன. காக் புரதத்தின் இயல்பான அமைப்பை உருவாக்குவதில் CA டொமைன் முக்கிய பங்கு வகிக்கிறது. NC டொமைன், உருவாகும் வைரஸ் துகளின் கலவையில் 2 மரபணு RNA மூலக்கூறுகளை (அதன் "துத்தநாக விரல்களின்" உதவியுடன்) சேர்ப்பதை உறுதி செய்கிறது. மேட்ரிக்ஸ் டொமைன்களின் தொடர்பு காரணமாக பாலிபுரோட்டீன் மூலக்கூறு ஆரம்பத்தில் டைமரைஸ் செய்கிறது. பின்னர் CA மற்றும் NC டொமைன்களின் தொடர்புகளின் விளைவாக டைமர்கள் ஹெக்ஸாமெரிக் (6 அலகுகள்) வளாகங்களாக இணைகின்றன. இறுதியாக, ஹெக்ஸாமர்கள், அவற்றின் பக்கவாட்டு மேற்பரப்புகளில் இணைந்து, முதிர்ச்சியடையாத கோள வடிவ விரியன்களை உருவாக்குகின்றன, அதன் உள்ளே மரபணு வைரஸ் RNA அடங்கியுள்ளது, NC டொமைனால் கைப்பற்றப்படுகிறது.
மற்றொரு முன்னோடி புரதமான Prl60Gag-Pol (160 kDa மூலக்கூறு எடை கொண்ட ஒரு புரதம்), rb புரதத்தை குறியாக்கம் செய்யும் பகுதியின் மேல்நோக்கி அமைந்துள்ள பகுதியில் காக் மரபணுவின் 3'-முனையின் மொழிபெயர்ப்பின் போது ரைபோசோமால் ஒரு பிரேம்ஷிஃப்ட்டின் விளைவாக ஒருங்கிணைக்கப்படுகிறது. இந்த காக்-போல் பாலிபுரோட்டீன் முழுமையற்ற காக் புரத வரிசை (1-423 அமினோ அமிலங்கள்) மற்றும் PR, RT மற்றும் IN டொமைன்களை உள்ளடக்கிய Pol வரிசைகளைக் கொண்டுள்ளது. காக்-போல் பாலிபுரோட்டீன் மூலக்கூறுகளும் இலவச பாலிரைபோசோம்களில் ஒருங்கிணைக்கப்பட்டு பிளாஸ்மா சவ்வுக்கு கொண்டு செல்லப்படுகின்றன. காக் பாலிபுரோட்டீன் காக் பாலிபுரோட்டீனில் உள்ளார்ந்த அனைத்து இடை மூலக்கூறு தொடர்பு தளங்கள் மற்றும் சவ்வு பிணைப்பு தளங்களைக் கொண்டுள்ளது. எனவே, காக்-போல் பாலிபுரோட்டீன் மூலக்கூறுகள் சவ்வுடன் இணைகின்றன, மேலும் காக் மூலக்கூறுகளுடன் சேர்ந்து, உருவாக்கும் விரியன்களில் சேர்க்கப்படுகின்றன, இதன் விளைவாக செயலில் உள்ள புரோட்டீஸின் தோற்றம் மற்றும் விரியன் முதிர்வு செயல்முறை தொடங்குகிறது. HIV-1 புரோட்டீஸ் ஒரு டைமர் வடிவத்தில் மட்டுமே அதிக அளவில் செயல்படுகிறது, எனவே, Prl60Gag-Pol இலிருந்து அதன் சுய-பிரித்தெடுப்புக்கு, இந்த மூலக்கூறுகளின் டைமரைசேஷன் தேவைப்படுகிறது. வெளியிடப்பட்ட செயலில் உள்ள புரோட்டீஸ் prl60Gag-Pol மற்றும் Gag55 ஐ அதனால் அங்கீகரிக்கப்பட்ட தளங்களில் வெட்டுகிறது என்ற உண்மையை விரியன் முதிர்ச்சி கொண்டுள்ளது; புரதங்கள் p17, p24, p7, p6, revertase, integrase ஆகியவை உருவாகின்றன மற்றும் வைரஸ் கட்டமைப்பில் அவற்றின் தொடர்பு ஏற்படுகிறது.
Env புரதம் எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தின் சவ்வுகளுடன் தொடர்புடைய ரைபோசோம்களில் ஒருங்கிணைக்கப்படுகிறது, பின்னர் அது கிளைகோசைலேட்டட் செய்யப்பட்டு, செல்லுலார் புரோட்டீஸால் gp120 மற்றும் gp41 ஆக வெட்டப்பட்டு, செல் மேற்பரப்புக்கு கொண்டு செல்லப்படுகிறது. இந்த நிலையில், gp41 சவ்வை ஊடுருவி, சவ்வின் உள் மேற்பரப்புடன் தொடர்புடைய காக் புரத மூலக்கூறின் மேட்ரிக்ஸ் டொமைன்களுடன் பிணைக்கிறது. இந்த இணைப்பு முதிர்ந்த விரியனில் பாதுகாக்கப்படுகிறது.
இவ்வாறு, வைரஸ் துகள்களின் கூட்டமானது, ஹோஸ்ட் செல்லின் பிளாஸ்மா சவ்வில் முன்னோடி புரதங்கள் மற்றும் தொடர்புடைய ஆர்.என்.ஏ மூலக்கூறுகளின் ஒருங்கிணைப்பு, முதிர்ச்சியடையாத விரியன்களின் உருவாக்கம் மற்றும் செல் மேற்பரப்பில் இருந்து மொட்டு மூலம் அவற்றின் வெளியீடு ஆகியவற்றைக் கொண்டுள்ளது. மொட்டுமிடத்தின் போது, விரியன் தன்னை ஒரு செல் சவ்வுடன் சூழ்ந்து கொள்கிறது, அதில் gp41 மற்றும் gp120 மூலக்கூறுகள் பதிக்கப்படுகின்றன. மொட்டுமிடத்தின் போது அல்லது, ஒருவேளை, விரியன்கள் வெளியான பிறகு, அவற்றின் முதிர்ச்சி ஏற்படுகிறது, இது ஒரு வைரஸ் புரோட்டீஸின் உதவியுடன் மேற்கொள்ளப்படுகிறது மற்றும் முன்னோடி புரதங்களான Pr55Gag மற்றும் Prl60Gag-Pol ஐ முதிர்ந்த வைரஸின் புரதங்களாகவும், சில கட்டமைப்பு வளாகங்களில் அவற்றின் தொடர்பிலும் புரோட்டியோலிடிக் வெட்டலைக் கொண்டுள்ளது. வைரஸ் உருவவியல் செயல்முறைகளில் முன்னணி பங்கு Pr55Gag ஆல் வகிக்கப்படுகிறது, இது முதிர்ச்சியடையாத விரியனை ஒழுங்கமைத்து ஒருங்கிணைக்கிறது; அதன் முதிர்ச்சியின் செயல்முறை ஒரு குறிப்பிட்ட வைரஸ் புரோட்டீஸால் முடிக்கப்படுகிறது.
நோயெதிர்ப்பு குறைபாட்டிற்கான காரணங்கள்
எச்.ஐ.வி தொற்றில் நோயெதிர்ப்பு குறைபாட்டிற்கான முக்கிய காரணங்களில் ஒன்று டி-ஹெல்பர்களின் பெருமளவிலான மரணம் ஆகும். இது பின்வரும் நிகழ்வுகளின் விளைவாக நிகழ்கிறது. முதலாவதாக, வைரஸால் பாதிக்கப்பட்ட டி-ஹெல்பர்கள் அப்போப்டோசிஸ் காரணமாக இறக்கின்றனர். எய்ட்ஸ் நோயாளிகளில், வைரஸ் பிரதிபலிப்பு, அப்போப்டோசிஸ் மற்றும் டி-ஹெல்பர்களின் எண்ணிக்கையில் குறைவு ஆகியவை ஒன்றோடொன்று இணைக்கப்பட்டுள்ளன என்று நம்பப்படுகிறது. இரண்டாவதாக, டி-கொலையாளிகள் வைரஸால் பாதிக்கப்பட்ட அல்லது உறிஞ்சப்பட்ட ஜிபிஎல்20 மூலக்கூறுகளை சுமந்து செல்லும் டி-செல்களை அடையாளம் கண்டு அழிக்கின்றன, அதே போல் வைரஸ்-பாதிக்கப்பட்ட மற்றும் வைரஸ்-பாதிக்கப்படாத டி-ஹெல்பர்களையும் அடையாளம் கண்டு அழிக்கின்றன, அவை பல டஜன் செல்களைக் கொண்ட சிம்பிளாஸ்ட்களை (சின்சிட்டியம்) உருவாக்குகின்றன (அவற்றில் சில அவற்றில் வைரஸ்களின் இனப்பெருக்கத்தின் விளைவாக இறக்கின்றன). அதிக எண்ணிக்கையிலான டி-உதவியாளர்கள் அழிக்கப்பட்டதன் விளைவாக, பி-லிம்போசைட்டுகளில் சவ்வு ஏற்பிகளின் வெளிப்பாடு இன்டர்லூகின்-2 க்கு குறைகிறது, பல்வேறு இன்டர்லூகின்களின் தொகுப்பு (வளர்ச்சி காரணிகள் மற்றும் பி-லிம்போசைட்டுகளின் வேறுபாடு - IL-4, IL-5, IL-6, முதலியன) சீர்குலைந்து, டி-கொலையாளி அமைப்பின் செயல்பாட்டில் இடையூறு ஏற்படுகிறது. நிரப்பு மற்றும் மேக்ரோபேஜ் அமைப்புகளின் செயல்பாடு அடக்கப்படுகிறது. வைரஸால் பாதிக்கப்பட்ட மேக்ரோபேஜ்கள் மற்றும் மோனோசைட்டுகள் நீண்ட காலத்திற்கு இறக்காது, ஆனால் அவை உடலில் இருந்து வைரஸை அகற்ற முடியாது. இறுதியாக, உடலின் சில எபிடெலியல் செல்களின் ஏற்பிகளுடன் (எச்ஐவியின் மாற்று பரிமாற்றத்தை மத்தியஸ்தம் செய்யும் ட்ரோபோபிளாஸ்ட் ஏற்பிகள் உட்பட) ஜிபிஎல்20 இன் கட்டமைப்பு மற்றும் ஆன்டிஜெனிக் ஒற்றுமை காரணமாக, பரந்த அளவிலான செயல்பாட்டைக் கொண்ட ஆன்டிரெசெப்டர் ஆன்டிபாடிகள் ஒருங்கிணைக்கப்படுகின்றன. இத்தகைய ஆன்டிபாடிகள் பல்வேறு செல்லுலார் ஏற்பிகளைத் தடுக்கவும், ஆட்டோ இம்யூன் கோளாறுகளால் நோயின் போக்கை சிக்கலாக்கவும் முடியும். எச்ஐவி நோய்த்தொற்றின் விளைவு நோயெதிர்ப்பு மண்டலத்தின் அனைத்து முக்கிய இணைப்புகளையும் தோற்கடிப்பதாகும். இத்தகைய நோயாளிகள் பல்வேறு வகையான நுண்ணுயிரிகளுக்கு எதிராக பாதுகாப்பற்றவர்களாக மாறுகிறார்கள். இது சந்தர்ப்பவாத நோய்த்தொற்றுகள் மற்றும் கட்டிகளின் வளர்ச்சிக்கு வழிவகுக்கிறது. எச்.ஐ.வி தொற்று உள்ள நோயாளிகளுக்கு, குறைந்தது மூன்று வகையான புற்றுநோய்கள் உருவாகும் ஆபத்து அதிகரிக்கிறது: கபோசியின் சர்கோமா; கார்சினோமா (தோல் புற்றுநோய் உட்பட); பி-செல் லிம்போமா, இது பி-லிம்போசைட்டுகளின் வீரியம் மிக்க மாற்றத்தால் ஏற்படுகிறது. இருப்பினும், எச்.ஐ.வி லிம்போசைட்டோட்ரோபிக் மட்டுமல்ல, நியூரோட்ரோபிக் ஆகும். இது ஏற்பி-மத்தியஸ்த எண்டோசைட்டோசிஸ் மற்றும் ஆஸ்ட்ரோசைட்டுகளால் வைரஸ்-பாதிக்கப்பட்ட லிம்போபிளாஸ்ட்களின் பாகோசைட்டோசிஸ் மூலம் மத்திய நரம்பு மண்டலத்தின் (ஆஸ்ட்ரோசைட்டுகள்) செல்களுக்குள் ஊடுருவுகிறது. வைரஸ் ஆஸ்ட்ரோசைட்டுகளுடன் தொடர்பு கொள்ளும்போது, சிம்பிளாஸ்ட்களும் உருவாகின்றன, இது இடைச்செல்லுலார் சேனல்கள் வழியாக நோய்க்கிருமி பரவுவதை எளிதாக்குகிறது. வைரஸ் மேக்ரோபேஜ்கள் மற்றும் மோனோசைட்டுகளில் நீண்ட நேரம் நீடிக்கும், எனவே அவை உடலில் ஒரு நீர்த்தேக்கமாகவும் விநியோகஸ்தர்களாகவும் செயல்படுகின்றன, அனைத்து திசுக்களிலும் ஊடுருவ முடியும். பாதிக்கப்பட்ட மேக்ரோபேஜ்கள் மத்திய நரம்பு மண்டலத்தில் எச்.ஐ.வி அறிமுகப்படுத்தப்படுவதிலும் அதன் சேதத்திலும் முக்கிய பங்கு வகிக்கின்றன. 10% நோயாளிகளில், முதன்மை மருத்துவ நோய்க்குறிகள் மத்திய நரம்பு மண்டலத்திற்கு சேதம் விளைவிப்பதோடு தொடர்புடையவை மற்றும் டிமென்ஷியாவாக வெளிப்படுகின்றன. இவ்வாறு, எச்.ஐ.வி நோயால் பாதிக்கப்பட்டவர்கள் 3 குழுக்களின் நோய்களால் வகைப்படுத்தப்படுகிறார்கள் - சந்தர்ப்பவாத தொற்றுகள்,கட்டி நோய்கள் மற்றும் மத்திய நரம்பு மண்டலத்திற்கு சேதம்.
எச்.ஐ.வி தொற்று நோயியல்
எச்.ஐ.வி தொற்றுக்கான மூல காரணம் ஒரு நபர் மட்டுமே - ஒரு நோய்வாய்ப்பட்ட நபர் அல்லது வைரஸ் கேரியர். மனித நோயெதிர்ப்பு குறைபாடு வைரஸ் (எச்.ஐ.வி) இரத்தம், விந்து, கர்ப்பப்பை வாய் திரவம்; பாலூட்டும் தாய்மார்களில் - தாய்ப்பாலில் உள்ளது. தொற்று பாலியல் ரீதியாகவும், இரத்தம் மற்றும் அதன் தயாரிப்புகள் மூலமாகவும், பிரசவத்திற்கு முன்பும், பிரசவத்தின்போதும், அதற்குப் பிறகும் தாயிடமிருந்து குழந்தைக்கும் ஏற்படுகிறது. உணவு, பானங்கள் மற்றும் பூச்சி கடித்தால் வைரஸ் தொற்று ஏற்பட்டதற்கான வழக்குகள் தெரியவில்லை.
போதைப்பொருள் பழக்கம் எய்ட்ஸ் பரவலுக்கு பங்களிக்கிறது. எச்.ஐ.வி பாதிப்பு ஒவ்வொரு ஆண்டும் அதிகரித்து வருகிறது. WHO இன் கூற்றுப்படி, 1980 முதல் 2000 வரை, 58 மில்லியன் மக்கள் எச்.ஐ.வி நோயால் பாதிக்கப்பட்டுள்ளனர். 2000 ஆம் ஆண்டில் மட்டும், உலகளவில் 5.3 மில்லியன் மக்கள் பாதிக்கப்பட்டுள்ளனர், மேலும் 3 மில்லியன் மக்கள் எய்ட்ஸ் நோயால் இறந்தனர். ஜனவரி 1, 2004 நிலவரப்படி, ரஷ்யாவில் 264 ஆயிரம் எச்.ஐ.வி நோயால் பாதிக்கப்பட்டவர்கள் பதிவு செய்யப்பட்டுள்ளனர். எச்.ஐ.வி நோயால் பாதிக்கப்பட்டவர்களில் பாதி பேர் தொற்று ஏற்பட்ட தருணத்திலிருந்து 11-12 ஆண்டுகளுக்குள் இறக்கின்றனர். 2004 ஆம் ஆண்டின் தொடக்கத்தில், ரஷ்யாவின் ஒவ்வொரு 100,000 ஆயிரம் குடிமக்களில், சுமார் 180 பேர் "எச்.ஐ.வி தொற்று" நோயறிதலுடன் வாழ்ந்தனர். இந்த அளவிலான நோயுற்ற தன்மையுடன், 2012 ஆம் ஆண்டுக்குள் ரஷ்யாவில் எச்.ஐ.வி நோயால் பாதிக்கப்பட்டவர்களின் மொத்த எண்ணிக்கை 2.5-3 மில்லியன் மக்களாக இருக்கும் என்று கணிக்கப்பட்டுள்ளது. எச்.ஐ.வி தொற்றுக்கு எதிரான போராட்டத்தின் சிக்கலானது பல காரணங்களைப் பொறுத்தது: முதலாவதாக, அதன் சிகிச்சை மற்றும் குறிப்பிட்ட தடுப்புக்கான பயனுள்ள முறைகள் எதுவும் இல்லை; இரண்டாவதாக, HIV தொற்றுக்கான அடைகாக்கும் காலம் 10 ஆண்டுகளுக்கு மேல் இருக்கலாம். அதன் காலம் T-லிம்போசைட் மற்றும் அதன் குரோமோசோமில் உள்ள DNA புரோவைரஸ் செயல்படுத்தும் தருணத்தைப் பொறுத்தது. வைரஸால் பாதிக்கப்பட்ட அனைவரும் எய்ட்ஸ் நோயால் பாதிக்கப்படுகிறார்களா அல்லது நோய் இல்லாமல் வைரஸை நீண்டகாலமாக எடுத்துச் செல்வது சாத்தியமா என்பது இன்னும் தெளிவாகத் தெரியவில்லை (இது சாத்தியமில்லை என்று தெரிகிறது). இறுதியாக, பல மனித நோயெதிர்ப்பு குறைபாடு வைரஸ்கள் (HIV-1, HIV-2) உள்ளன, அவற்றுக்கிடையேயான ஆன்டிஜெனிக் வேறுபாடுகள் குறுக்கு-நோய் எதிர்ப்பு சக்தி உருவாவதைத் தடுக்கின்றன. சிமியன் நோயெதிர்ப்பு குறைபாடு வைரஸின் (SIV) கண்டுபிடிப்பு HIV இன் தோற்றம் பற்றிய கேள்விக்கு வெளிச்சம் போட்டது. SIV அதன் மரபணு அமைப்பில் HIV ஐப் போன்றது, ஆனால் அதன் நியூக்ளியோடைடு வரிசையில் கணிசமாக வேறுபடுகிறது. HIV-2 அதன் செரோலாஜிக்கல் பண்புகளில் HIV-1 மற்றும் SIV க்கு இடையில் ஒரு இடைநிலை நிலையை ஆக்கிரமித்துள்ளது, மேலும் அதன் நியூக்ளியோடைடு வரிசையில் SIV க்கு நெருக்கமாக உள்ளது. இது சம்பந்தமாக, VM Zhdanov, HIV-1, HIV-2 மற்றும் SIV வைரஸ்கள் ஒரு பொதுவான மூதாதையரிடமிருந்து தோன்றியதாக பரிந்துரைத்தார். ஆர். காலோவின் கூற்றுப்படி, SIV களில் ஒன்று எப்படியோ மனித உடலுக்குள் நுழைந்து, அங்கு தொடர்ச்சியான பிறழ்வுகளுக்கு உட்பட்டு, HIV-1, HIV-2 மற்றும் அதன் பிற வடிவங்கள் தோன்றுவதற்கு வழிவகுத்தது.
எச்.ஐ.வி தொற்று அறிகுறிகள்
மனித நோயெதிர்ப்பு குறைபாடு வைரஸ், நோயின் நோய்க்கிருமி உருவாக்கத்தை பெரும்பாலும் தீர்மானிக்கும் சில அம்சங்களைக் கொண்டுள்ளது. இந்த வைரஸ் மிக அதிக இனப்பெருக்க விகிதத்தைக் கொண்டுள்ளது, இது அதன் ஒழுங்குமுறை கூறுகளால் தீர்மானிக்கப்படுகிறது (செயலில் உள்ள நிலையில் 5 நிமிடங்களில் 5,000 விரியன்கள் வரை ஒருங்கிணைக்கப்படுகின்றன). இணைவு புரதம் (gp41) இருப்பதால், வைரஸ் பாதிக்கப்பட்ட மற்றும் பாதிக்கப்படாத டி-ஹெல்பர்களின் இணைவு காரணமாக விரிவான ஒத்திசைவு கட்டமைப்புகளை உருவாக்கத் தூண்டுகிறது, இதன் விளைவாக அவற்றின் வெகுஜன மரணம் ஏற்படுகிறது. பெரிய அளவில் உருவாகும் ஜிபிஎல்20 புரத மூலக்கூறுகள் இரத்தத்தில் சுதந்திரமாகச் சுழன்று, பாதிக்கப்படாத டி-ஹெல்பர்களின் ஏற்பிகளுடன் பிணைக்கப்படுகின்றன, இதன் விளைவாக அவை டி-கொலையாளிகளால் அங்கீகரிக்கப்பட்டு அழிக்கப்படுகின்றன. வைரஸ் செல்லிலிருந்து செல்லுக்கு இடைச்செருகல் சேனல்கள் வழியாக பரவக்கூடும், இந்நிலையில் அது ஆன்டிபாடிகளுக்கு மோசமாக அணுகக்கூடியதாக மாறும்.
எச்.ஐ.வி தொற்றுக்கான மருத்துவ அளவுகோல்கள்
பெரியவர்களில், குறைந்தது இரண்டு கடுமையான அறிகுறிகள் இருந்தால், அவற்றுடன் குறைந்தபட்சம் ஒரு சிறிய அறிகுறியாவது இருந்தால், நோயெதிர்ப்பு குறைபாட்டிற்கான பிற அறியப்பட்ட காரணங்கள் இல்லாதபோது (புற்றுநோய், பிறவி நோயெதிர்ப்பு குறைபாடு, கடுமையான பட்டினி போன்றவை) எச்.ஐ.வி தொற்று கண்டறியப்படுகிறது. கடுமையான அறிகுறிகள் பின்வருமாறு:
- 10% அல்லது அதற்கு மேற்பட்ட எடை இழப்பு;
- நீடித்த காய்ச்சல் நிலை, இடைவிடாத அல்லது நிலையானது;
- நாள்பட்ட வயிற்றுப்போக்கு.
சிறிய அறிகுறிகள்: தொடர்ச்சியான இருமல், பொதுவான தோல் அழற்சி, மீண்டும் மீண்டும் வரும் ஹெர்பெஸ் ஜோஸ்டர், வாய்வழி மற்றும் தொண்டை அழற்சி, நாள்பட்ட ஹெர்பெஸ் சிம்ப்ளக்ஸ், பொதுவான லிம்பேடனோபதி. கபோசியின் சர்கோமா, கிரிப்டோகாக்கல் மூளைக்காய்ச்சல், நிமோசைஸ்டிஸ் நிமோனியா ஆகியவற்றின் முன்னிலையில் மட்டுமே எய்ட்ஸ் நோயறிதல் செய்யப்படுகிறது. நோயின் மருத்துவ படம் அதனுடன் வரும் சந்தர்ப்பவாத தொற்றுநோயால் பாதிக்கப்படுகிறது.
மனித நோயெதிர்ப்பு குறைபாடு வைரஸை (எச்.ஐ.வி) வளர்ப்பதற்கான முறைகள்
லுகேமிக் TCV4 லிம்போசைட்டுகளிலிருந்து பெறப்பட்ட TCV4 லிம்போசைட்டுகளின் ஒரே ஒரு குளோனின் செல்களில் HIV-1 மற்றும் HIV-2 ஐ வளர்க்க முடியும் - H9. HIV-1 நன்றாக இனப்பெருக்கம் செய்யும் ஆஸ்ட்ரோசைட் செல்களின் மோனோலேயர் கலாச்சாரங்களையும் இந்த நோக்கங்களுக்காகப் பயன்படுத்தலாம். விலங்குகளில் சிம்பன்சிகள் HIV-1 க்கு ஆளாகின்றன.
வெளிப்புற சூழலில் வைரஸின் எதிர்ப்பு குறைவாக உள்ளது. இது சூரிய ஒளி மற்றும் புற ஊதா கதிர்வீச்சின் செல்வாக்கின் கீழ் இறந்துவிடுகிறது, பொதுவாகப் பயன்படுத்தப்படும் கிருமிநாசினிகளுடன் சிகிச்சையளிக்கப்படும்போது 30 நிமிடங்களுக்குள் 80 °C வெப்பநிலையில் அழிக்கப்படுகிறது - 20-30 நிமிடங்களுக்குள். வைரஸ் கொண்ட பொருட்களை கிருமி நீக்கம் செய்ய, மைக்கோபாக்டீரிசைடல் கிருமிநாசினிகளைப் பயன்படுத்துவது அவசியம், ஏனெனில் அவை அதிக எதிர்ப்பைக் கொண்ட நுண்ணுயிரிகளுக்கு எதிராக பயனுள்ளதாக இருக்கும்.
எச்.ஐ.வி தொற்றுக்கான ஆய்வக நோயறிதல்
வைரஸ் பரவுதல் மற்றும் எச்.ஐ.வி தொற்றைக் கண்டறிவதற்கான முக்கிய முறை என்சைம் இம்யூனோஅஸ்ஸே ஆகும். இருப்பினும், சளி சவ்வுகளின் எபிதீலியல் செல்கள் வழியாக இம்யூனோகுளோபுலின்களைக் கொண்டு செல்லும் ஏற்பிகள் உட்பட, சில மனித உயிரணுக்களின் ஏற்பிகளுடன் gpl20 கட்டமைப்பு மற்றும் ஆன்டிஜென் ஒற்றுமையைக் கொண்டிருப்பதால், gpl20 க்கு எதிரான ஆன்டிபாடிகளுடன் தொடர்புடைய ஆன்டிபாடிகள் உடலில் தோன்றக்கூடும். இந்த வழக்கில், தவறான-நேர்மறை ELISA முடிவுகள் இருக்கலாம். எனவே, அனைத்து நேர்மறை எதிர்வினை செராவும் இம்யூனோபிளாட்டிங் முறை அல்லது வெஸ்டர்ன் ப்ளாட்டிங் மூலம் கூடுதல் பகுப்பாய்விற்கு உட்படுகின்றன. இந்த முறை, எலக்ட்ரோஃபோரெடிக் பிரிப்புக்குப் பிறகு ஆய்வின் கீழ் உள்ள ஆன்டிபாடிகளை அடையாளம் காண்பதையும், பின்னர் பெயரிடப்பட்ட இன எதிர்ப்பு ஆன்டிபாடிகளைப் பயன்படுத்தி சோதனை செய்வதையும் அடிப்படையாகக் கொண்டது. வைரஸை வளர்ப்பதில் உள்ள சிக்கலான தன்மை காரணமாக வைராலஜிக்கல் முறை அரிதாகவே பயன்படுத்தப்படுகிறது. H9 லிம்போசைட் குளோன் வைரஸ் ஆன்டிஜென்களைப் பெறப் பயன்படுத்தப்படுகிறது - கண்டறியும் சோதனை அமைப்புகளின் தேவையான கூறுகள். CPR முறை வைரமியாவின் ஆரம்ப கட்டத்தில் வைரஸைக் கண்டறிய அனுமதிக்கிறது.
எச்.ஐ.வி தொற்று சிகிச்சை
ரிவர்ஸ் டிரான்ஸ்கிரிப்டேஸ் (ரிவர்டேஸ்) அல்லது வைரஸ் புரோட்டீஸின் செயல்பாட்டை திறம்பட அடக்கும் மருந்துகளைக் கண்டுபிடிப்பது அல்லது ஒருங்கிணைப்பது அவசியம். அவை டிஎன்ஏ புரோவைரஸ் உருவாவதைத் தடுக்கும் மற்றும் (அல்லது) வைரஸின் உள்செல்லுலார் இனப்பெருக்கத்தைத் தடுக்கும். எச்.ஐ.வி-பாதிக்கப்பட்ட நோயாளிகளுக்கு சிகிச்சையளிப்பதற்கான நவீன உத்தி, வைரஸ் புரோட்டீஸை (மருந்துகளில் ஒன்று) மற்றும் ரிவர்ஸேஸ் (2 வெவ்வேறு மருந்துகள்) - ஒருங்கிணைந்த (டிரிபிள்) சிகிச்சையைத் தடுக்கும் மருந்துகளின் ஒருங்கிணைந்த பயன்பாட்டின் கொள்கையை அடிப்படையாகக் கொண்டது. ரஷ்யாவில், எச்.ஐ.வி-பாதிக்கப்பட்ட நோயாளிகளுக்கு சிகிச்சையளிக்க, 2 உள்நாட்டு மருந்துகளின் ஒருங்கிணைந்த பயன்பாடு பரிந்துரைக்கப்படுகிறது: பாஸ்பாசைடு மற்றும் கிரிக்ஸிவன், இது இனப்பெருக்கத்தின் ஆரம்ப மற்றும் பிற்பகுதியில், குறிப்பாக அசிடோதைமிடின் குறைக்கப்பட்ட செயல்பாடுடன் எச்.ஐ.வி இனப்பெருக்கத்தை குறிப்பாக அடக்குகிறது.
குறிப்பிட்ட நோய்த்தடுப்பு சிகிச்சையின் சிக்கல் என்னவென்றால், வைரஸ்-குறிப்பிட்ட சைட்டோடாக்ஸிக் லிம்போசைட்டுகளை அடிப்படையாகக் கொண்ட பயனுள்ள செல்-மத்தியஸ்த நோய் எதிர்ப்பு சக்தியை உருவாக்குவதை உறுதி செய்யும் தடுப்பூசியை உருவாக்க வேண்டிய அவசியம். இத்தகைய நோய் எதிர்ப்பு சக்தி Thl உதவியாளர்களால் வழங்கப்படுகிறது. வைரஸ்-நடுநிலையாக்கும் ஆன்டிபாடிகள் உட்பட, ஆன்டிபாடிகள், HIV தொற்றை அடக்குவதில் பயனற்றவை மட்டுமல்ல, உயர் மட்டத்தில் அவை செல்-மத்தியஸ்த நோய் எதிர்ப்பு சக்தியை அடக்குகின்றன. எனவே, HIV எதிர்ப்பு தடுப்பூசி, முதலில், இரண்டு முக்கிய தேவைகளைப் பூர்த்தி செய்ய வேண்டும்: a) முற்றிலும் பாதுகாப்பாக இருக்க வேண்டும் மற்றும் b) T-சைட்டோடாக்ஸிக் லிம்போசைட்டுகளின் செயல்பாட்டைத் தூண்டுகிறது. கொல்லப்பட்ட (செயலிழக்கப்பட்ட) வைரஸ்கள் மற்றும் அதிக பாதுகாப்பு பண்புகளைக் கொண்ட தனிப்பட்ட ஆன்டிஜென்களிலிருந்து பெறப்பட்ட பல்வேறு தடுப்பூசி வகைகளின் செயல்திறன் ஆய்வு செய்யப்பட்டு வருகிறது. இத்தகைய ஆன்டிஜென்களை விரியன்களிலிருந்து தனிமைப்படுத்தலாம் அல்லது வேதியியல் ரீதியாக ஒருங்கிணைக்கலாம். மரபணு பொறியியல் முறைகளின் அடிப்படையில் உருவாக்கப்பட்ட தடுப்பூசி முன்மொழியப்பட்டுள்ளது. இது வலுவான நோயெதிர்ப்பு பண்புகளைக் கொண்ட ஆன்டிஜென்களின் தொகுப்புக்கு பொறுப்பான HIV மரபணுக்களைச் சுமந்து செல்லும் ஒரு மறுசீரமைப்பு தடுப்பூசி வைரஸ் ஆகும். HIV நோய்த்தொற்றின் நீண்ட அடைகாக்கும் காலம் மற்றும் நோய்க்கிருமியின் அதிக மாறுபாடு காரணமாக இந்த தடுப்பூசிகளின் செயல்திறன் குறித்த கேள்விக்கு கணிசமான நேரம் தேவைப்படுகிறது. எச்.ஐ.வி-க்கு எதிராக மிகவும் பயனுள்ள தடுப்பூசியை உருவாக்குவது ஒரு அவசர அடிப்படைப் பிரச்சினையாகும்.

